柳叶刀杂志研究发现氧化还原信号分子和线粒体的关系
线粒体是动态的生物能细胞器,其维持着基因组中大约1500个蛋白质。线粒体或核基因组中的突变会破坏细胞代谢和同质性功能。线粒体疾病是遗传性遗传病中最常见和最严重的一类,其特点是临床、生化和遗传异质性、诊断性失调和缺乏疾病修饰疗法。随着高通量组学技术的广泛应用,线粒体生物学和医学得到了很好的发展,同时也衍生出来了许多新的线粒体疾病治疗方法。对生物能量和生物合成线粒体功能的新认识加快了原发性线粒体疾病的遗传学诊断,并确定了新的线粒体病理机制和治疗干预的新靶点。随着我们进入线粒体医学的新时代,组学技术将继续揭示尚未解决的线粒体问题,为改善线粒体疾病患者的结果铺平道路。
线粒体功能和障碍
线粒体是复杂的动态细胞器,其执行与细胞代谢和均质稳定有关的许多功能。通过氧化磷酸化(OXPHOS)产生细胞能量是线粒体的标志,但线粒体在钙稳态,caspase依赖性细胞凋亡启动,细胞应激反应,血红素生物合成,硫代谢和胞质蛋白降解中也起作用。线粒体的独特特征是线粒体DNA(mtDNA),一种来自细胞器内共生进化起源的小环状基因组(仅编码37种基因).mtDNA编码13种OXPHOS蛋白;其余大约1500种线粒体蛋白质组蛋白质在核基因组中编码并通过复杂的系统转移至线粒体.
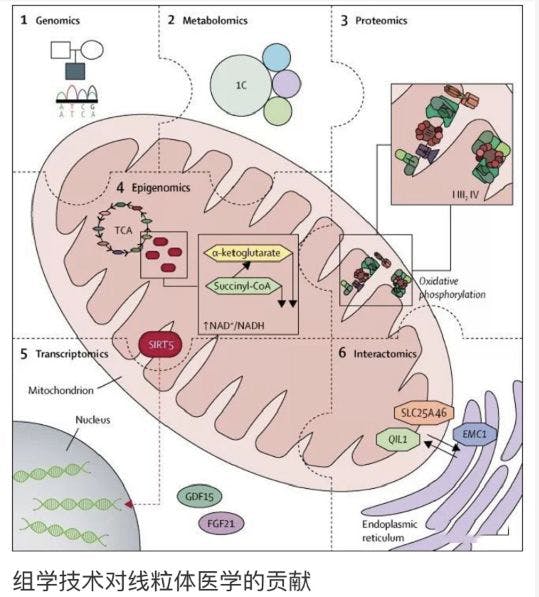
据报道,有350多个来自线粒体和核源的基因发生突变,导致线粒体疾病。这些遗传病可定义为突变主要或继发导致OXPHOS功能障碍或线粒体结构和功能的其他紊乱,包括线粒体超微结构紊乱、辅助性因子和维生素产生异常,或线粒体内其他代谢过程受损,包括三羧酸(TCA)循环和丙酮酸代谢。线粒体疾病表现出不均匀的表型和生化表现。这种变异,加上对线粒体病理生理学的不完全了解,使线粒体疾病面临诊断挑战,缺乏疾病修饰治疗方法。然而,近年来,高通量组学技术-即能够检测生物体中多种分子成分差异的高通量技术(包括基因组学、转录组学、蛋白质组学、代谢组学和表观基因组学)-以及复杂的生物信息学工具已经揭示了线粒体功能及其对细胞健康和疾病的贡献的新细节。这些新技术对线粒体医学的几个支柱具有宝贵的价值,包括阐明线粒体结构和功能的基本方面,加强线粒体疾病的遗传诊断,并为改善线粒体疾病的疗效提供新的治疗目标的见解。
增强对氧化磷酸化的理解
也许线粒体最具特色的功能是它被称为细胞的“发电站”。这一替代名称背后的基本原理是通过OXPHOS产生细胞能量。OXPHOS系统从细菌到高等真核生物都是保守的,它由五种多聚酶组成,称为复合物I至V,以及两个移动电子载体(辅酶Q10[CoQ 10]和细胞色素c[cyt c])。配合物I(NADH:醌氧化还原酶[CI])通过NADH氧化和CoQ 10还原作用将四个质子从线粒体膜(IMM)中泵入膜间空间(IMS)。配合物II(琥珀酸-coq氧化还原酶[CII])通过CoQ 10的还原将电子从fad依赖的源中转移出来;然而,这种酶并不能从imm上抽运质子。配合物Ⅲ(泛醌-细胞色素c氧化还原酶[CIII])氧化还原CoQ 10,减少Cytc,释放四个质子进入IMS。最终的电子受体是分子氧,它在复合物IV(细胞色素c氧化酶(CIV)催化的反应中接受四个电子,形成水分子。这一反应与质子转移到IMS是耦合的。这些复合物的活性所产生的质子梯度产生了一个质子动力,由F1F0-ATP合酶(复合物V)用来将ADP磷酸化为ATP,ATP是细胞的主要能量货币。
线粒体作为信号细胞器和细胞稳态的守门人
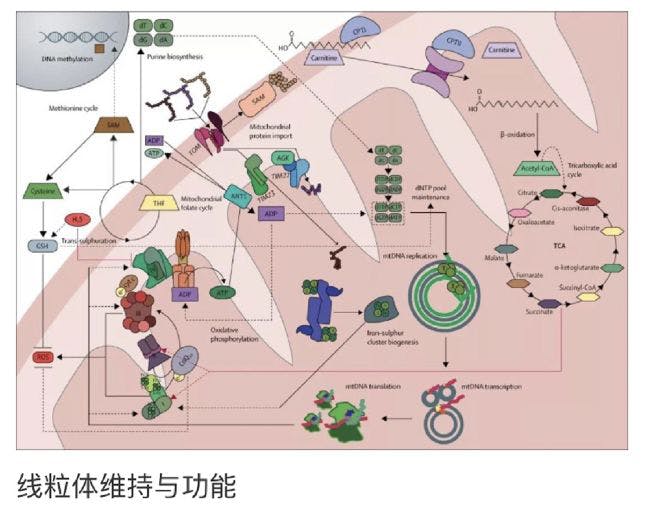
线粒体生物学中的一个新概念是线粒体作为信使细胞器在与细胞核和其他亚细胞室的恒定通信中的作用,以滴定能量的产生和代谢产物到细胞的特定需要和营养可用性。从线粒体到细胞质的逆行信号的细节,包括ROS、线粒体膜电位、关键中间代谢产物、线粒体生物能(AMP/ATP)和氧化还原(NAAD+/NADH)比值、线粒体膜上的钙通量和GasoTurmim。在生理浓度下,如硫化氢促使线粒体ROS产生,虽然最初假定是有害的,并有助于线粒体和细胞病理学,但对细胞信号转导和基因表达的调节似乎是不可或缺的。OcLee,H2O2和其他ROS微调线粒体形态,通过改变裂变的平衡(碎片线粒体)和融合(长管线粒体)。在细胞的其他地方,线粒体H2O2通过调节激酶驱动的途径参与调节细胞存活、自噬和细胞迁移。在生物体水平上,重要的是注意到ROS信号不同地影响不同的细胞类型。包括TCA循环、叶酸代谢和硫代谢在内的几种融合代谢途径的全部或部分成分。
不仅这些途径中的酶和代谢物对它们各自的代谢功能很重要,而且这些物种也具有信号分子的多效性作用。除了产生进给OXPHOS系统的还原当量外,TCA循环具有众多的补体作用,包括为复杂脂质、蛋白质、碳水化合物和核苷酸的生物合成提供前体。周期性中间体对乙酰半胱氨酸和α-酮戊二酸分别影响组蛋白乙酰化和去甲基化的信号作用。蛋白质琥珀酰化需要琥珀酰辅酶A,的翻译后修饰已被提出。在健康和疾病(包括免疫功能和癌症)中有广泛的细胞效应。此外,α-酮戊二酸:琥珀酸比值最近已被证明影响人类干细胞分化。但应注意的是生理相关的证据。F琥珀酰化仍然是稀缺的。线粒体ATP合成受损与AMP:ATP比值的增加有关,导致AMP激活激酶(AMPK)的激活,这是一种主要的细胞生物能传感器,被认为是营养依赖信号的震源。确定AMPK磷酸化的靶点,包括线粒体裂变因子MFF,从而连接营养传感和线粒体动力学。AMPK也改变线粒体NAAD+:NADH氧化还原比,导致sirtuin介导的主转录辅激活子PGC1α的去乙酰化。增强其基因表达,促进线粒体生物合成。
基因组学技术在线粒体诊断中的应用
基因组学:线粒体基因组学最初的时代开始于30年前,伴随着零星的大规模线粒体DNA重排发生在具有Leber遗传性视神经病变(LHON)的家族中,这些患者伴有粗糙红纤维肌病和母系遗传性mtDNA点突变。线粒体基因组的小体积和已知序列导致大量有关新的疾病相关突变的报道,跨越线粒体DNA的几乎每一个碱基。在此期间,很明显许多儿科线粒体疾病病例必然是由核基因缺陷的基础上,间接证据表明受感染家族血亲发病率增加,许多患者没有mtDNA突变。寻找导致OXPHOS缺陷的核基因突变仍然难以捉摸,直到识别由缺乏复合物II引起的Leigh综合征患者中的SDHA突变为止,这是唯一由核基因编码的OXPHOS复合物。尽管有这种突破,但多数情况下的线粒体疾病仍然对基因诊断具有抗性,因为可用方法的局限性限于候选基因测序,有或没有先前的连锁分析或(在血缘家族情况下)纯合性绘图。
转绿组学:WES和WGS是强有力的技术,但仅在25-50%的线粒体病患者中产生了遗传原因.未能诊断100%病例的原因很复杂,但在确定de -novo突变,52个隐藏剪接位点缺陷,拷贝数变体,插入或缺失事件,以及在深度内含子或调控区域或难治性区域如重复序列中的突变。亲子三重测序可以鉴定de novo突变,并且是在解码发育障碍(DDD)和英国基因组100000基因组(100K)项目中有效使用的策略.最近的研究证明了整个转录组测序的能力使用RNA测序技术(RNAseq)优先选择候选基因(例如那些表达减少或甚至是单等位基因表达的)并鉴定影响剪接的深层内含子变异 .RNAseq也有助于解释由WGS鉴定的变异。例如,原发性肌肉RNA样本的RNAseq成功鉴定了50例疑似遗传性肌病患者中21%的遗传缺陷,这些患者的诊断已经对WES和WGS有抗药性.该研究强调了在未解决的病例中研究临床相关组织的重要性。然而,由于许多线粒体疾病基因是管家基因,它们广泛表达,包括在培养的皮肤成纤维细胞中。因此,Kremer及其合作者在培养的皮肤成纤维细胞中成功地使用了RNAseq来诊断10%的48例疑似线粒体疾病的患者,后者在WES后未被诊断 .RNAseq确实存在挑战,受到批次影响并需要强大的方法学和过滤因为它依赖于在被调查的组织中表达的目的基因,对于在成纤维细胞中不表达的基因以及在受影响的组织不能被表达的基因(脑,心脏)中,重编程的iPS细胞的RNAseq可能是有希望的方法。
蛋白组学:最近被纳入线粒体诊断设备的另一种工具是定量蛋白质组学。在对所有大约1500个预测的人类线粒体蛋白进行编目时,正在取得进展,最近在酿酒酵母和人类细胞中研究了线粒体蛋白质组的线粒体定位。此外,基于质谱交联相互作用组分析已被用于研究线粒体蛋白的许多相互作用,并将C17orf89(NDUFAF8)鉴定为Leigh综合征患者突变的新型复合物I装配因子。所有这些信息都是无价的在鉴定新的线粒体疾病的疾病基因时,可能有助于解决WES或WGS后未确诊的25-50%的病例。
代谢组学:几十年来一直在寻找线粒体疾病的生物标志物和治疗目标。线粒体疾病最初的生化标志物,如乳酸和丙酮酸,敏感性低,特异性低。质谱代谢组学可对生物样品中的数千个小分子进行全面、系统的分析,是寻找线粒体疾病难以捉摸的理想生物标志物或药物靶标的最新技术。代谢组学可用于分析线粒体功能障碍的众多下游效应,包括氧化应激、NAD/NADH氧化还原失衡和能量缺乏在全球范围内的后果。
新的线粒体疾病机制
对线粒体疾病病理学的支持机制知之甚少。然而,近年来,使用组学技术来阐明新的病理生理学线粒体机制已经导致令人兴奋并且经常出乎意料的发展。由于OXPHOS无效而产生的生物能量缺乏是解释线粒体疾病病理生理学的起点,对于影响OXPHOS成分突变的患者更是如此。然而,未能在体外和体内检测到ATP缺陷已经表明能量缺陷不能完全解释线粒体疾病的病理生理学。其他假定的线粒体病理机制包括增加的ROS产生(或减少的抗氧化剂保护),线粒体膜电位损失,线粒体钙处理受损,
线粒体疾病可能由具有已知作用的蛋白质突变引起,包括OXPHOS结构亚基和组装因子,线粒体DNA维持,线粒体翻译,线粒体脂质和线粒体动力学。相反,数十种线粒体疾病突变影响功能未确定的蛋白质。阐明这些未表征的蛋白质的活性为线粒体病理生理学提供了有价值的见解,并且已经通过非目标全局分析得到了实质性的促进。线粒体蛋白质 - 蛋白质相互作用的一项新的生物素化亲近测定的调查使功能理解的修改线粒体载体蛋白SLC25A46,突变与Leigh综合征和视神经萎缩。这些研究在几个生理过程包括线粒体动力学牵连SLC25A46,由于患者细胞中观察到的线粒体hyperfused表型。SLC25A46的识别结合伴侣提出了其他作用,包括作为线粒体接触位点和嵴组织系统(MICOS)的一个组成部分,一个负责连接嵴连接到IMM的蛋白质复合物,以及通过与内质相互作用的线粒体脂质稳定性(EMC),它负责磷脂从内质网(细胞磷脂合成位点)转移到线粒体。这些过程中的缺陷有助于扰乱线粒体超微结构,改变线粒体DNA的遗传和功能失调的OXPHOS。在具有QIL1 MICOS亚基突变的患者中已经观察到类似的病理学和神经表型
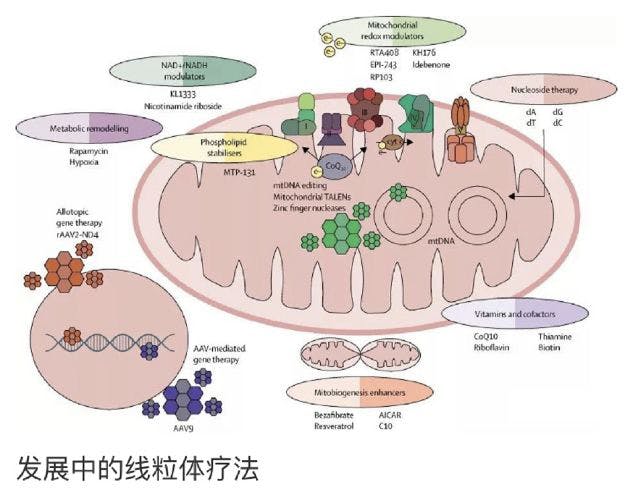
基因治疗
遗传途径治疗线粒体疾病也可以分为两组 - 针对mtDNA,和那些旨在纠正核基因缺陷。由于mtDNA特有的特征,即高拷贝数导致异质性现象(不同细胞中不同比例的突变型和野生型mtDNA共存),独特的遗传密码和独特的母系遗传,需要不同的策略。
线粒体基因组编辑
对于异质性mtDNA突变,选择性破坏突变序列的基因组编辑是一种有吸引力的选择,并且已经使用日益复杂的工具超过15年来追求。初步的原理证明研究表明限制性核酸内切酶可以选择性地破坏突变的mtDNA,使野生型基因组完整无损。随后的研究中使用锌指核酸酶和线粒体的TALEN以限制性内切酶定位到线粒体,最初是在线粒体病的细胞模型以及最近在整体动物。CRISPR-Cas9基因编辑在技术上在对线粒体DNA上的应用,会因为RNA进入线粒体的问题而变得非常棘手。